



دیابت و افزایش پروتئین که سبب بروز خصوصیات آلزایمر می شود
شواهد بسیاری وجود دارد که نشاندهنده ی ارتباط بیماری دیابت وآلزایمر است، اما مکانیسم فیزیولوژیکی تأثیر دیابت بر عملکرد مغز و تأثیرات روانشناختی آن کاملاً مشخص نشده اند. درمطالعه ی جدیدی که در Aging cell منتشر گردید برای اولین بار مشخص شد که دیابت سبب افزایش ویژگیهای پیری می شود که زمینه ی وقایع پاتولوژیکی اولیه ی ابتلا به آلزایمر می باشد.
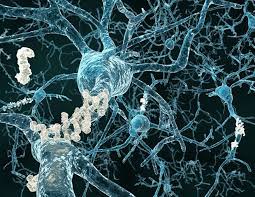
تصویر میکروسکوپی نشان می دهد که رگهای خونی مغز موش (سبز) توسط پپتیدهای بتاآمیلوئید (قرمز) احاطه شده اند، جزئی از پلاکهای آمیلوئیدی که در مغز بیماران مبتلا به آلزایمر مشاهده می شود . محققین مرکز salkدریافتند که این پپتیدها در مغز موشهای دیابتی ومسن تجمع می یابند این یافته ها ارتباط بین دیابت و آلزایمر را آشکار می کند.
گروه تحقیقاتی salkنشان دادند که دومشخصه اصلی آلزایمر افزایش تجمع آمیلوئید بتا (Abeta)و پروتئین tauدرمغز موش های دیابتی است به خصوص در سلولهایی که رگهای خونی را در مغز احاطه کرده اند. Abetaیک پپتید با تا خوردگی اشتباه است که بنظر می رسد بخشی از علت ابتلا به آلزایمرمی باشد. این پپتید با تجمع در آسترویست ها (سلولهای ستاره ای شکل در مغز) سبب آزاد شدن مولکولهای التهابی می گردد و می تواند سبب تخریب نورونها گردد. قبلاً این مورد درمدلهای حیوانی موش مبتلا به دیابت نوع 1 (T1D)نشان داده نشده بود .pamela Maher می گوید : مطالعه ی ما از ارتباط دیابت، پیری وآلزایمر حمایت می کند. ما نشان دادیم که ابتلا به دیابت نوع 1 سبب تجمع آمیلوئید بتا مرتبط با عروق درمغز شده وموجب تسریع پیری در مغز می شود.
این نتایج نشان می دهد که سیستم عروقی مغز کاندید خوبی برای اهداف درمانهای جدید برای آلزایمر در مراحل اولیه می تواند باشد.
آلزایمر و دیابت دو بیماری رو به افزایش با سرعتی هشدار دهنده در امریکا هستند. آلزایمر حدود ده درصد جمعیت بالای 65 سال و 50 درصد جمعیت بالای 85 سال را تحت تأثیر خود قرار داده است و دیابت 8 درصد (تقریباً 26 میلیون نفر) از افراد امریکایی به خصوص افراد بالای 65 سال را درگیر کرده است .
پاملا ماهر می گوید: هنوز نتوانسته ایم مکانیسم دقیق افزایش Abetaو پروتئین tau را در مغز موش شناسایی کنیم اما یافته ها نشان میدهد که تغییراتی در آستروسیت ها و همچنین ایجاد سایر فرایندهای پیش التهابی و اتصال پروتئین ها با مولکولهای قند (که بنام گلیکوزیلاسیون غیر آنزیمی مشهور است) میتواند موجب بروز این مسئله شود. آستروسیت ها نقش کلیدی درحفظ سلولهای عصبی درمغز بازی می کنند. دیابت سبب افزایش التهاب مزمن محیطی وافزایش گلیکوزیلاسیون غیر آنزیمی شده و این تغییرات درمغز سبب تغییر عملکرد آستروسیت ها ونهایتاً بروز تغییراتی شبه به آلزایمر می شوند. تمام سلولهای عصبی به دلیل نیاز به موادغذایی از نزدیک با رگهای خونی درتماس هستند (برای دریافت قند واکسیژن ) ، آستروسیت ها انتقال مواد غذایی بین رگهای خونی و سلولهای مغزی را تسهیل می کنند. تجمع Abetaدر جایگاه هایی که آستروسیت ها با رگهای خونی اندرکنش دارند می تواند انتقال مواد غذایی را دچار اختلال کند. نوعی از تجمع Abetaدر مدلهای حیوانی موش آزمایشات پاملاماهر در بیماران مبتلا به آلزایمر درانسان نیز مشاهده می شود.
به منظور بررسی سهم دیابت در پاتولوژی مرتبط با آلزایمر در مغز سالمندان، محققین مرکز salkدیابت نوع 1 را در دو مدل از موشها القاء کردند.
در یکسری از موشها که به SAMP8معروف هستند پیری شتاب می یابد واین موشها به زوال زود هنگام در یادگیری و حافظه مبتلا می شوند. دراین مدل از موشها تغییرات مغزی مشابه با تغییراتی است که در آلزایمر دیده می شود. در مجموعه دیگری از موشها که بنام SAMR1معروف هستند تغییرات سن بصورت نرمال است.
دکتر ماهر و همکارانش با استفاده از این مدلهای حیوانی متوجه ی نحوه ی اندرکش بیماری دیابت نوع یک با سن و تأثیر آن در پاتولوژی بیماری آلزایمر شدند.
آنها نشان دادند که بیماری دیابت نوع 1 سبب ایجاد تغییرات گسترده ای درمغز هر سویه ی موش می شود که این تغییرات پیری زود هنگام را تسریع می کنند .
مطالعات مرکز salkبرای اولین بار نشان داد که این تغییرات مشابه با تغییراتی است که در موشهای غیر دیابتی مسن سویه ی SAMP8ایجاد می شود این تحقیقات تغییرات پاتولوژیکی منحصر به فردی نظیر افزایش مارکرهای التهابی درموشهای مسنSAMP8مبتلا به دیابت را برای اولین بار مشخص نمود.
بر خلاف تمام مطالعاتی که با استفاده از موش بروی آلزایمر انجام می شود موشهای گروه دکتر ماهر برای افزایش تولید Abetaیا tauانسانی ، دستکاری ژنتیکی نشدند وتمام مشاهدات برآمده از تولید Abetaو پروتئینی tauبود .
منبع: www. sciencedaily.com